![]()
![]()
Das berühmteste Beispiel einer oszillierenden chemischen Reaktion wurde vom russischen Chemiker B.P. Belousow entdeckt und später vom A.M. Zhabotinski systematisch untersucht. Der genaue Verlauf dieser Reaktion ist recht kompliziert (21 verschiedene, zum Teil nur kurzzeitig erscheinende, Reaktions-partner nehmen an 18 Teilreaktionen teil).


Die chemischen Vorgänge, welche die Farbumschläge verursachen laufen etwa wie folgt ab:
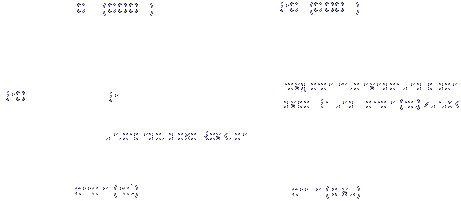
In der Lösung reagiert zunächst das Bromat-Ion (BrO3–) mit dem Bromid-Ion (Br–), wobei elementares Brom (Br2) entsteht. Nun wird die Malonsäure (CH2(COOH)2) durch das entstandene Brom in Brommalonsäure (BrCH(COOH)2) umgewandelt. Das Bromat-Ion würde auch mit dem rotgefärbten Indikator Ferroin reagieren, wenn es dabei durch die Bromid-Ionen nicht gehindert wäre (schon eine Bromid-Konzentration von 10–6 M verhindert diese Reaktion vollständig). Das rote Ferroin ist eine organische Eisenverbindung mit der Oxidationszahl von Eisen = +II, welche durch Oxidation in das himmelblaue Ferriin (Oxidationszahl von Fe = +III) übergeht.:
Erst wenn durch die oben erwähnte Umsetzung mit den Bromat-Ionen und der Malonsäure alle Bromid-Ionen verbraucht sind, kann es zu einer Reaktion der Bromat-Ionen mit rotem Ferroin kommen, wobei dieses zu blauem Ferriin oxidiert wird. Die blaue Farbe der Lösung ist jedoch nicht stabil, weil nun die Brommalonsäure anfängt, das Ferriin wieder zu rotem Ferroin zu reduzieren. Da bei dieser Reaktion auch Bromid zurückgebildet wird, kann der Kreislauf von vorn beginnen.
|
|
|