Kohlendioxid und Carbonat-Spezies¶
„Kohlensäure“ ist nicht Kohlensäure¶
Die Übertragung eines Wasserstoffkerns H+ von einem Teilchen auf ein anderes verläuft in wässriger Lösung normalerweise extrem schnell. Alle in der Schule behandelten Brønsted-Reaktionen wie
laufen diffusionskontrolliert ab [1] mit Geschwindigkeitskonstanten um \(10^{9}\) bis \(10^{10} M^{-1} s^{-1}\) [2]. Lösungen von „Kohlensäure“ in Wasser hingegen reagieren relativ langsam mit Hydroxid-Ionen. Wieso?
Tatsächlich lässt sich z.B. mit spektroskopischen Methoden zeigen, dass „Kohlensäure“ zum grössten Teil aus gelöstem CO2 besteht. Das Gleichgewicht
liegt also weit auf der Seite des in Wasser gelösten CO2 (3D-Modell des Wasserclusters).
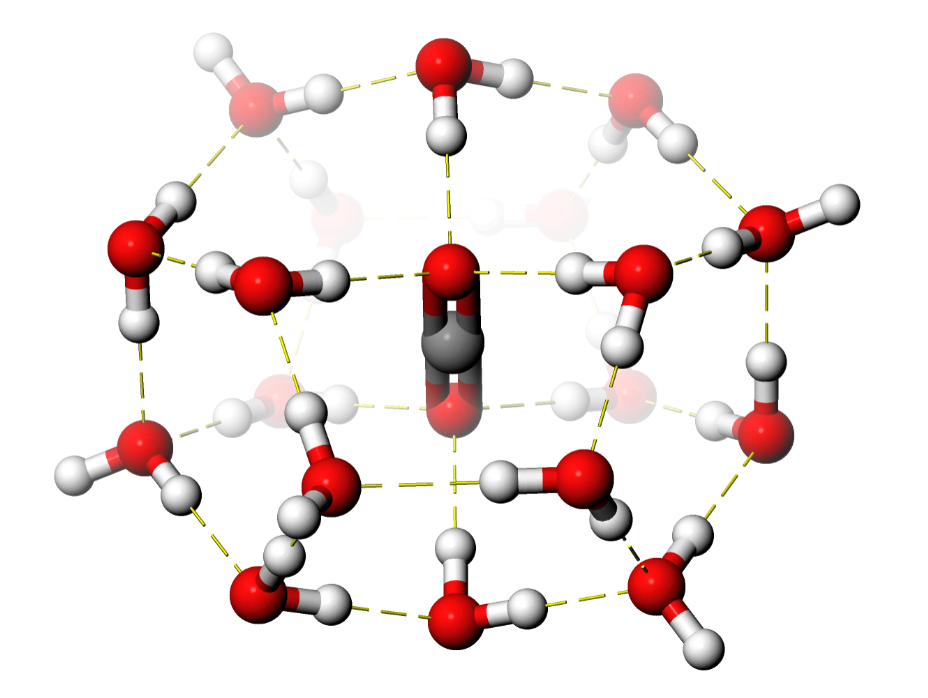
Abb. 1: Kohlendioxid-Molekül in wässriger Lösung, umgeben von Wassermolekülen.¶
Die eigentliche Kohlensäure, also die Spezies H2CO3, wurde hingegen in wässriger Lösung offenbar noch nie direkt nachgewiesen [1]. Sie kann allerdings unter speziellen Bedingungen hergestellt und kristallisiert werden (3D-Modell eines Kohlensäurekristalls):
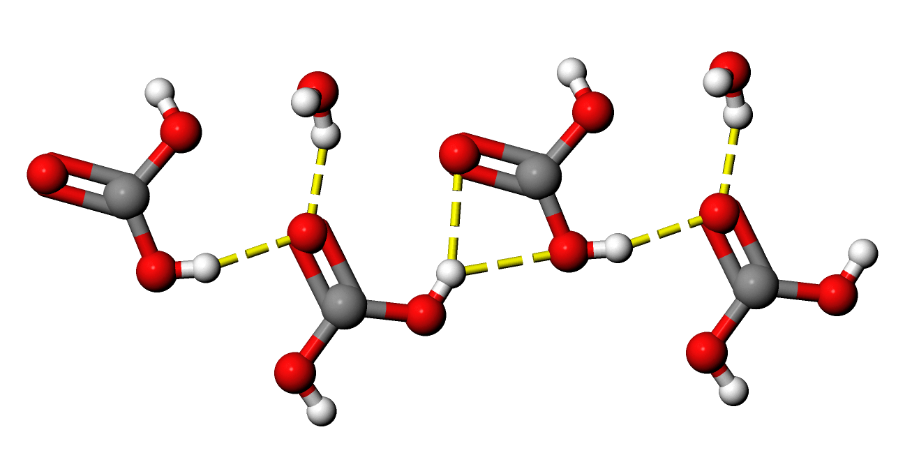
Abb. 2: Kristallstruktur von Kohlensäure¶
In einer „Kohlensäurelösung“ reagieren die Hydroxidionen (OH-) somit gar nicht mit H2CO3, sondern direkt mit den CO2-Molekülen. Es handelt sich dabei also nicht um eine einfache Protolyse und daher ist diese Reaktion sehr viel langsamer als letztere; Gleichgewichtsreaktionen mit CO2 stellen sich in wässriger Lösung nur relativ langsam ein ([3]). Aus diesem Grund verwenden Lebewesen das Enzym Carboanhydrase, um diese Reaktion zu beschleunigen.
Die Halbwertszeiten für die unkatalysierte Reaktion beträgt unter typischen Bedingungen bei pH 7 etwa 13 min, bei pH 10 etwa 0.8 s [1]. In Gasphase würde diese exotherme Reaktion allerdings ohne Energiebarriere und daher sehr schnell verlaufen. Die Energiebarriere kommt durch Wassermoleküle zustande, welche die Reaktanden umgeben (Abb. 1) und bis zum Übergangszustand zum Teil abgestreift werden müssen. Das obige 3D-Modell zeigt, dass die Wassermoleküle für eine Reaktion sehr ungünstig angeordnet sind. Abb. 3 zeigt einen typischen Übergangszustand dieser Reaktion (3D-Modell des Übergangszustandes mit Molekülorbitalen), in dem allerdings nur ein besonders stark über Wassertoffbrücken gebundenes Wassermolekül eingezeichnet ist [4]:
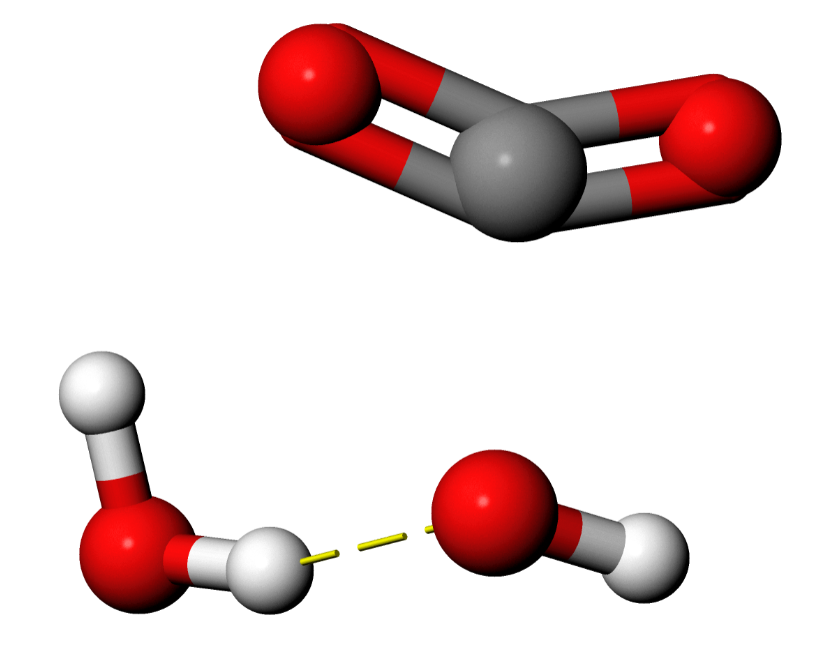
Abb. 3: Übergangszustand der Reaktion zwischen Kohlendioxid und einem Hydroxid-Ion¶
Das CO2-Molekül ist in diesem Übergangszustand bereits durch die Interaktion mit dem Hydroxidion verzerrt.
Abb. 4 zeigt, in welchen Anteilen die verschiedenen Kohlensäure- und Carbonatspezies bei verschiedenen pH-Werten im Gleichgewicht auftreten (Speziierung von Kohlensäure). Ausser der Reaktion von CO2 mit H2O oder OH- verlaufen alle Reaktionen praktisch diffusionskontrolliert.
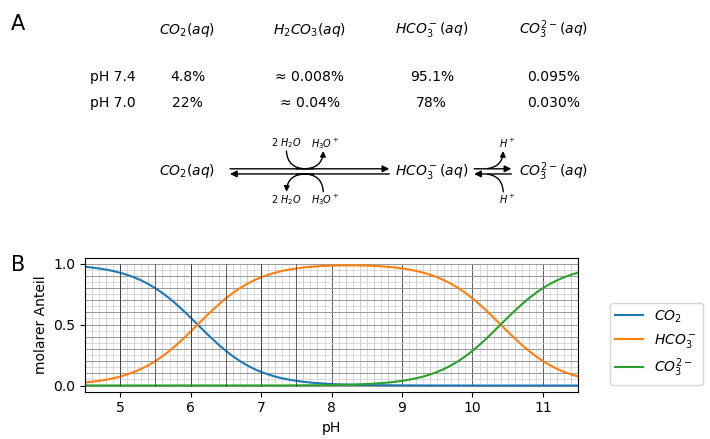
Abb. 4: Speziierung der verschiedenen Carbonat-Spezies bei verschiedenen pH-Werten. Verwendet wurde ein pKS-Wert für H2CO3*, also eigentlich CO2 + H2O, von pKS = 6.46. Unter physiologischen Bedingungen rechnet man oft mit tieferen pKS-Werten bis etwa pKS = 6.1.¶
Zum Vergleich ist in Abb. 5 die Titrationskurve einer CO2-Lösung (0.1 mol/L) zu sehen.
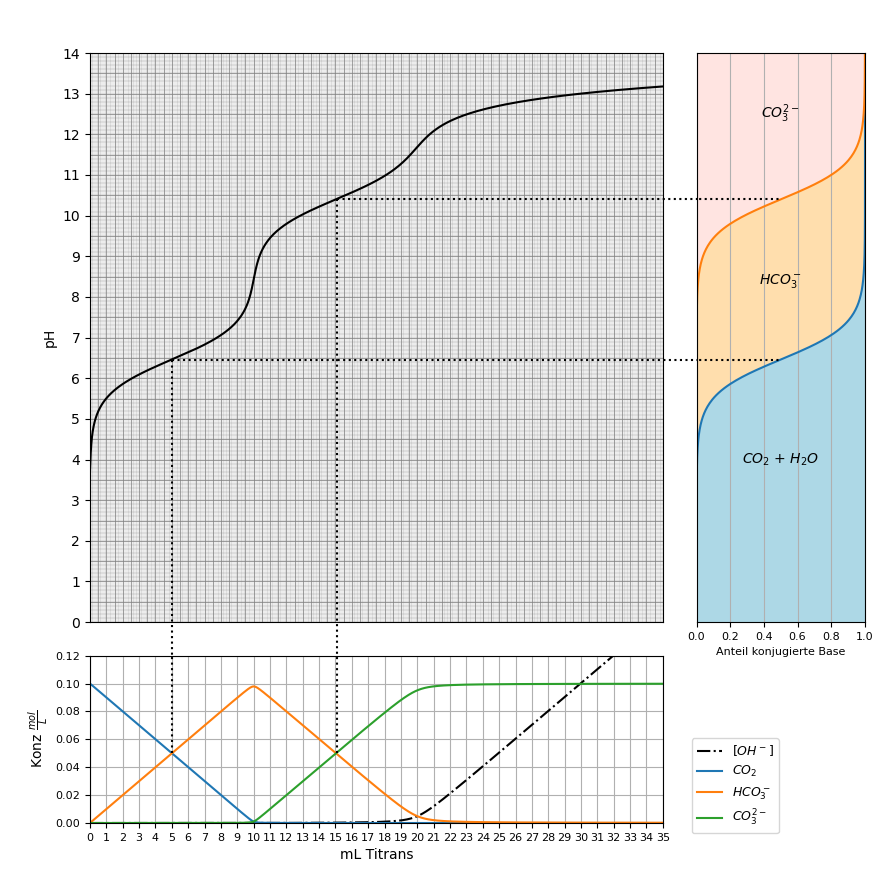
Abb. 5: Titrationskurve von 100 mL einer CO2-Lösung (0.1 mol/L) mit NaOH (1 mol/L). Zu sehen sind rechts die entsprechenden Pufferkurven und unten die relativen Anteile der verschiedenen Spezies.¶