Kristallstrukturen
© Urs Leisinger 2016
Mit dem Feld "Filtern" können die Einträge durchsucht werden. Die Option Basis-Auswahl blendet exotischere Kristallstrukturen aus und zeigt solche, die für die Mittelschule interessant sind.
Natürlich kann man auch mit ctrl + f nach Textelementen suchen.
Die meisten Strukturen stammen aus der Crystallography Open Database Quellen findet man jeweils unter Datei/Datei zeigen.
Anleitung zur Darstellung von Kristallstrukturen mit Beispieldatei.
Weitere organische Kristallstrukturen.
weitere Filter
C9H8O4
Komplexsalz aus einem Komplex mit Alizarin mit Oxid- Natrium- und Vanadium(IV)-Ionen mit N-Dimethylmethanamid (Dimethylformamid) und einem 1,4,5,6-Tetrahydropyrimidinium-Kation
C38H35N4NaO11V
Ausschnitt
Offenkettiges Triphosphat (ohne H-Atome)
Al(NH4)HP3O10
Auswahl
AlBr3
Ausschnitt
[Al2(OH)4(H2O)4]Br2 Mehrkerniger Aluminiumkomplex mit Bromid als Gegenion
Aluminiumchlorid
AlCl3
Polyeder
nur
Polyeder bei gewählten
Aluminiumchlorid hexahydrat
AlCl3 * 6 H2O bzw.
[Al(H2O)6]Cl3
Polyeder
nur
Polyeder bei gewählten
Aluminiumchlorid hydroxid: Salz mit zweikernigem Komplex
AlClH6O4 bzw.
[Al2(OH)4(H2O)4]Cl2
Polyeder bei gewählten
AlF3
grosser Ausschnitt
Polyeder bei gewählten
Al(NO3)3 * 6 H2O
Polyeder bei gewählten
AlN
Polyeder
nur
Polyeder bei gewählten
Al2O3 Aluminiumoxid, Korund
Polyeder
nur
Polyeder bei gewählten
AlOOH Aluminiumoxid hydroxid (γ-AlOOH)
Polyeder bei gewählten
A(OH)3 Aluminiumhydroxid, Gibbsit (γ-AlOOH)
Polyeder bei gewählten
C4H9N1O2 γ-Aminobuttersäure
NH3CH2CH2CH2COO bzw.
NH2CH2CH2CH2COOH
Kristall
Ungewöhnlich sind sowohl die Konformation des Hydrogentartrat-Ions als auch die Geometrie der Amino-Gruppe des Kations.
C6H14N2O6
grosser Ausschnitt>
Verketteter Kupfer(I)-Komplex mit Bindungen zwischen den Kupfer-Ionen
[Cu(NH3)Cl]
NH3 Ammoniak
NH4CH3COO
NH4N3
Polyeder
nur
Enthält das sehr aussergewöhnliche Bifluorid-Anion HF2-
NH4(HF2)
Polyeder
nur
NH4Cl
Polyeder
nur
Offenkettiges Triphosphat (Ohne H-Atome)
Be2(NH4)P3O10
(NH4)(C(NH2)3)Zr({NTA})2 * 2H2O
C13H26N6O14Zr
Ausschnitt
NH4NO3
(NH4)2(C2O4) * H2O
grosser Ausschnitt
Ohne H-Atome
NH4I3
Für Amylopectin, die andere Stärkeform: siehe Polysaccharide-Modelle
C57H116O40 ()
C6H7N
Ausschnitt
Zahnschmelz besteht aus Hydroxylapatit, Fluorapatit entsteht beim Zähne putzen.
Ca5OH(PO4)3Hydroxylapatit
Ca5F(PO4)3Fluorapatit
C6H14N4O2 * H2O Arginin
(C6H15N4O2)2(C4H4O6) Arginintartrat
Schwerlösliche arsenhaltige Mineralien können durch Reaktion mit Sauerstoff zu Arsen(III)- oder Arsen(V)-Verbindungen oxidiert werden, die gut wasserlöslich sind, bei Arsenopyrit beispielsweise: 2 FeAsS + 7 O₂ + 6 H₂O → 2 Fe³⁺ + 2 H₃AsO₄ + 2 SO₄²⁻. Gelangt durch menschliche Aktivität Sauerstoff ins Grundwasser, kann dieser Prozess zu Vergiftungen führen.
FeAsS Arsenopyrit
As4S4 Realgar, Arsen(II)-sulfid
As2S3 Orpiment, Arsen(III)-sulfid eine Ebene
Arsenige Säure entsteht durch die Reaktion von Arsenoxid mit Wasser: As₂O₃ + 3 H₂O → 2 H₃AsO₃. Arsenate entstehen durch zusätzliche Oxidation
As2O3 Arsen(III)-oxid
H3AsO3 Arsenige Säure (As(III)-Säure), existiert nur in Lösung
H3AsO4 Arsensäure (As(V)-Säure), exisitert nur in Lösung
Zn3(AsO4)2 Zinkarsenat
NaH2AsO4 Natriumdihydrogenarsenat
Azobenzole
(C7H5N3)(C7H7O3S)
p-Cyanobenzen-diazoniumtosylat
(C7H5N2O2)Cl * H2O
2-Carboxybenzen-diazonium-chlorid Monohydrat
C12H12N3+ , C8H4NO6- , H2O
Anilingelb mit Hydrogen-5-nitroisophthalat
(4-(Phenylazo)anilinium-hydrogen-5-nitroisophthalat Monohydrat)
C12H10N2
(E)-Azobenzen
C12H10N2
(E)-Decafluoro-azobenzen
C12H10N2
(Z)-Decafluoro-azobenzen
C12H10N2
(E)-Dibromohexafluoro-azobenzen
C12H10N2
(Z)-Dibromohexafluoro-azobenzen
C12H10N2
(E)-Dodecoxy-Tetrafluoro-iodo-azobenzen
C12H10N2
(Z)-Dodecoxy-Tetrafluoro-iodo-azobenzen
C10H8 Azulen
Ba(OH)2 * 3 H2O
Komplexbindungen
Unitcell
Ba(NO3)2
Unitcell
Anion dieses Salzes ist das Pernitrid-Ion, N2--
BaN2
Unitcell
Ba2(Co2F7Cl)
BaSO4
BaC4H4O6
C4H4BaO6
Ausschnitt
Andere Kristallstruktur
Benzol
Benzen-Moleküle ordnen sich im Kristall fast senkrecht zueinander an. Dies liegt daran, dass der aromatische Ring zum zentrum hin negative, bei den H-Atomen positive Partialladungen trägt (Partialladungen in Benzen). Flach aufeinanderliegende Aromaten gibt es bei der Aren-Perfluoraren-Interaktion oder 'aromatic donor–acceptor interaction' (siehe z.B. Hexafluorbenzen)
C6H6 Benzol (Benzen)
BaC4H4O6
C4H4BaO6
Ausschnitt
Andere Kristallstruktur
Bariumtitanat ist piezoelektrisch: Bei Temperaturen über 120°C befindet sich das Titan(IV)-Ion genau im Zentrum des Oktaeders der umgebenden O-Atome (Kubische Struktur). Bei Temperaturen zwischen 0°C und 120°C liegt das Titan-Ion hingegen in eine Richtung verschoben vor. Dadurch wird jede Einheitszelle zu einem Dipol. In der Summe führen alle diese gleich gerichteten Dipole zu einer makroskopisch messbaren Spannung. Durch Zusammendrücken eines solchen Piezokristalls wird die Stärke der Dipole verändert und so wird eine Spannung erzeugt. Umgekehrt verformt sich ein solcher Kristall, wenn eine äussere Spannung angelegt wird
BaTiO3 verzerrte Struktur bei 25°C
Ansicht 2
Polyeder 1
Polyeder 2
BaTiO3 (Kubisch)
Ansicht 2
Polyeder 1
Polyeder 2
Benzol
Benzen-Moleküle ordnen sich im Kristall fast senkrecht zueinander an. Dies liegt daran, dass der aromatische Ring zum zentrum hin negative, bei den H-Atomen positive Partialladungen trägt (Partialladungen in Benzen). Flach aufeinanderliegende Aromaten gibt es bei der Aren-Perfluoraren-Interaktion oder 'aromatic donor–acceptor interaction' (siehe z.B. Hexafluorbenzen)
C6H6 Benzol (Benzen)
C13H10O Benzophenon
Regelmässiges Gitter aus Fe(III) und Fe(II), wobei jedes vierte Fe(II) mitsamt seinen Cyanid-Liganden durch an die Fe(III)-Ionen koordiniere Wassermoleküle ersetzt ist. Das Kristallgitter enthält zudem nicht koordinierte H2O-Moleküle, deren H-Atome und teils auch O-Atome in der Neutronenstreuungs-Kristallanalyse diffus erscheinen.
Fe4[Fe(CN)6] (kein cif)
cif
Si2Be4H2O9
Al2Be3Si6O18
[Cu(C10H8N2)(CHO2)2], CH2O2 Bipyrimidinkupfer(II)-formiat (-methanoat)
[Co(C10H8N2)2(CO3)][HCO3] * 5H2O
C22H27CoN4O11
Ausschnitt
[Co(NCS)2(C4H12N2)2]NCS
[Au(C7H9N)2][AuCl4]
Komplex-Indikator
[Co(C13H11N4O)2(CH4O)2]
C50H44CeFe2N5O19
[Cu(C7H5O3)2(C6H6N2O)2]
Kristall
[Co(C2H8N2)2(SCN)(S2O3)*H2O
Organischer Supraleiter
C20H16I3S16
Wismuttriiodid
BiI3
[Cu(C7H5O3)2(C6H6N2O)2]
Kristall
PbI2
Polyeder bei gewählten
| Pb3O4 | Ausschnitt |
Polyeder bei gewählten
PbSBleiglanz, Blei(II)-sulfid
Polyeder bei gewählten
Kubisches BN hat Diamantstruktur und ist nach Diamant das zweithärteste bekannte Mineral, hexagonales hat eine graphit-ähnliche Struktur, ist ebenso weich, hat Gleiteigenschaften, leitet den elektrischen Strom aber schlechter
BNBornitrid, kubisch
BNBornitrid,hexagonal
C4H10
2-Azaniumylethylazaniumtetrachlorocuprat(II)
C4H14N2[CuCl4]
Buttersäure
Die originale Struktur enthält keine Informationen zu H-Atomen. H-Atome sind mit Hilfe von Jmol eingefügt.
C4H8O2
CdCl2
Polyeder
CdF2
Polyeder
CsCl Caesiumchlorid
Polyeder bei gewählten
Cs(C7H5O3)(H2O)]
Kristall
Ca3AsN
Unitcell
Polyeder bei gewählten
CaC2
Polyeder
nur
Polyeder bei gewählten
CaCO3 Aragonit
CaCO3 Calcit, || Kristallflächen
CaCO3 Calcit, || Unitcell
CaCl2 Calciumchlorid
CaCl2 * 2 H2O Dihydrat
CaCl2 * 4 H2O Tetrahydrat
CaCl2 * 4 H2O γ-Calciumchlorid Tetrahydrat
CaCl2 * 6 H2O Hexahydrat
Polyeder bei gewählten
Fluorit, Flussspat
CaF2 Fluorit
Veränderung des geladenen Ausschnitts:
Kation
Anion
alles
Polyeder bei gewählten
CaH2 Calciumhydrid
Ca(OH)2
Polyeder bei gewählten
Struktur ohne H-Atome
Ca(OCl)2[Ca(OH)2]2
Ca(C2O4) * 3H2O Trihydrat
Ca(C2O4) * 2H2O Dihydrat (Nierenstein)
CaSO4 Anhydrit
CaSO4 * 2 H2O Gips
Gips, Ausschnitt
Polyeder bei gewählten
C4H12CaO10
Ausschnitt
wasserfrei
Ethylendiamin-Komplex
[CoCO3(C2H8N2)2]ClO4
C40H56 β-Carotin (Caroten)
Kristall
C12H20O10
Siehe auch Polysaccharide
Cellulose sind fadenartige Moleküle aus Glucose-Einheiten. Man könnte nun erwarten, dass Cellulosefäden ebenso wie Glucose über sehr viele Wasserstoffbrücken miteinander verknüpft sind.
α-Cellulose:
Ebene
Ausschnitt
β-Cellulose:
Ebene
Ausschnitt
C8H13NO5
Für andere Polysaccharide: siehe Polysaccharide-Modelle
α-Chitin
β-Chitin
Chitin (Proteopedia)
Werkstoff Chitin
Cl2
(Mg{2.518}Fe{2.482})Al{1.2}Si{3.8}O18H10 Chamosit
ClF3
HCl
Desoxycholat und Tris
Natriumcholat propanol monosolvat
Natriumcholat-methanol monosolvat
CrCl2 Chrom(II)-chlorid
CrCl3 Chrom(III)-chlorid
CrCl3 * 6 H2O
[Cr(H2O)6]Cl3 Chrom(III)-chlorid Hexahydrat
Spezielle Oxidationsstufen
CrN
Polyeder
nur
Unitcell
weisser Asbest
Mg3Si2O9H4
C6H8O7 Citronensäure
Co(C4H4O6)(C10N2H8)*5H2O
C14H22CoN2O11
Ausschnitt
Cobaltchloride, mit Formalladungen, jeweils Salz und einzelner Komplex
| CoCl2 | wasserfrei | |
| CoCl2* H2O | Monohydrat | |
| CoCl2*2 H2O | Dihydrat | |
| CoCl2*6 H2O | Hexahydrat |
Polyeder bei gewählten
Struktur mit Dicyanoaurat-Brücken
Co(Au(CN)2)2
CoC6H6O7 * H2O
gross
Co(NO3)2
Polyeder
nur
Ausschnitt
Unitcell
Spezielle Oxidationsstufen
Co2N
Polyeder
nur
Unitcell
CoO2 Cobalt(IV)-oxid, siehe Lithiumionen-Akku
CoO Cobalt(II)-oxid
LiCoO2
Lithium-Cobalt(III)-oxid, siehe Lithiumionen-Akku, entladen
Cobalthydroxid
Co(OH)2 Cobalt(II)-hydroxid
CoO(OH) Cobalt(III)-oxid-hydroxid
Bei diesem Salz befinden sich die H-Atome erstaunlicherweise genau zwischen den Oxid-Ionen.
CRISPR-assoziierte Endonuclease mit DNA und RNA
Kronenether
KC26H28O8 Dibenzo-18-crown-6-kalium-benzochinonid
Ohne Anionen
C54H80K3Mn3O58Ru3
Catena-(tris((18-crown-6)-kalium)-heptakis(m2-oxalato)-tetra-aqua-bis(oxalato)-tri-ruthenium(III)-tri-mangan(II))
nur Kronen
Komplex-Indikator
C21H20O6 Curcumin
Cyclodextrin 1
C48H80O40{, n }C1H4O1{, m }H2O
(C42H70O35)2(C8 H8 O3)2*28H2O Cyclodextrin 2 (bis(Beta-cyclodextrin) bis(4-hydroxybenzoesäure-methylester) clathrat hydrat)
C132H176N8 O79 Cyclodextrin mit Azo-Verbindung
Cyclodextrin 4
Cyclodextrin 5 (mit Wasser)
Cyclodecaamylose mit Wasser
C5H10
C3H7NO2S Cystein
C6H12N2O4S2 Cystin
C10H22
4-[3,5-Bis(2-hydroxyphenyl)-1H-1,2,4-triazol-1-yl]benzoesäure dimethylformamid monosolvat. Komplex mit Eisen
C24H22N4O5
C42H26FeN6O8 (Komplex mit Eisen)
(deoxyribonucleic acid, DNA)
Dodecamere
A-DNA ; H272C232N92O140P22
B-DNA ; H272C232N92O146Mg1P22
Z-DNA ; H268C228N96O140P22
G-Quadruplex
DNA-Abschnitt mit interkalierendem DA5 (5-Bromo-9-amino-N-ethyl(diaminomethyl)acridin-4-carboxamid)
Triacylglycerine
C53H100O6 1,3-Dipalmitoyl-2-oleoylglycerin (ungesättigt)
C55H106O6 1-Palmitoylglycerol-2,3-distearoylglycerin (gesättigt)
C57H108O6 1,2-Distearoyl-3-elaidoylglycerol (enthält trans-Fettsäure)
Membranlipide
C43H80O13P 1,2-Diacyl-SN-glycero-3-phosphoinositol, Membranlipid
C40H80NO8P 1,2-Diacyl-SN-glycero-3-phosphocholin, Membranlipid (Quelle)
C41H83NO8P 1,2-Diacyl-SN-glycero-3-phosphocholin, Membranlipid (Quelle)
C43H78NO8P Membranlipid (Quelle)
Membranlipid-ähnliche Lipide
H42C20NO6P * nH2O Membranlipid-ähnliches Lipid mit Cholin-Baustein
H42C20NO6P * nH2O Ebene aus Membranlipidähnlichen Lipiden mit Cholin-Baustein
H42C20NO6P * nH2O Kristall aus Membranlipidähnlichen Lipiden mit Cholin-Baustein
[Cu(NH3)2(C2H3O3)2]
C4H12CuN2O6
[Zn(C2H3O3)2(H2O)2]
C4H10O8Zn
Ba2CoF9Fe
Cs2[AgCl2][AuCl4]
CH2Cl2 Dichlormethan
I2O5 Iod
I2C4H4
C4H8O2
Pentachloroantimonat(III)-Komplex
| [C2H8N)2[SbCl5] | Ausschnitt |
C6H8O3
C4H12O3P2
[Al2{EDTA}(OH)2(H2O)2]
C10H18Al2N2O12
Ausschnitt
EDTA ist ungewöhnlich protoniert.
K3H{EDTA} * 2 H2O
C10H17K3N2O10
Ausschnitt
[CuH2{EDTA}]
C10H14CuN2O8
Ausschnitt
FeCl2 Eisen(II)-chlorid
FeCl2 * 2 H2O Eisen(II)-chlorid Dihydrat
FeCl2 * 4 H2O
Eisen(II)-chlorid Tetrahydrat
FeCl3 Eisen(III)-chlorid
FeCl3 * 6 H2O
[FeCl2(H2O)4]Cl * 2 H2O Eisen(III)-chlorid Hexahydrat
ohne H-Atome
Mit etwa korrekt ausgerichteten H-Atomen
FeF3 Eisen(III)-fluorid
, Eisen(III)-gallat dihydrat.
Die Wasserstoffatome der Wassermoleküle und Hydroxy-Gruppen fehlen.Analoge Struktur mit Wasserstoffatomen: Mangan(II)-gallat
Fe(C7H3O5)*2H2O
C7H7FeO7
Ausschnitt
FeOOH
Komplexsalz mit einem Hexaaquaeisen(III)-Komplex
Fe(ClO4)3 * 9 H2O Nonahydrat
Ausschnitt
Fe3(PO4)2 * 8 H2O Nonahydrat
Aussschnitt
FeSO4
Eisen(II)-sulfat
T4 Endonuclease
(Mg{1.948}Ca{0.052})Si2O6
CH3COOHEssigsäure
Ausschnitt
Ethylendiammoniumthiocyanat
Ausschnitt
C2H6O2
Ausschnitt
Ethylacetat
C4H8O2
Acetylen
C2H2
Ein Zwitterion analog zum Coenzym bzw. Vitamin B12
| C64H95CoN14O14P | Ausschnitt |
1,2-Diaminoethan, Ethan-1,2-diamin, EDA, en
C2H8N2
F2
Na2C20H10O5 * 8H2O
F2C2O3
JSmol bildet keine Wasserstoffbrücken mit Fluor. Um die Wasserstoffbrücken einzuzeichnen, muss man im Reiter ZMWW also die Option "WBR an Auswahl ... [ein/aus]" verwemdem.
HF Fluorwasserstoff
(Mg1{0.8}Fe0{.2})SiO4
GaBr3
GaBr3
GaN
Polyeder
nur
Unitcell
KSi3Al3O12H2, Muskovit
K(Mg,Fe)3(AlSi3O10)(F,OH)2 Biotit
C6H12O6
Glucose, Traubenzucker
Molekül
Ausschnitt
Kristall
C10H17N3O6S reduziertes Glutathion
C20H32N6O12S2 * 8H2O oxidiertes Glutathion
Zwei verschiedene Formen (Kristallstrukturen)
NH2CH2COOH β-Glycin
NH2CH2COOH γ-Glycin
C3H8O3
Si3Al2Fe2{.58}Mg{0.27}Ca{0.12}O12 Almandin
Ca3Al2Si3O12 Grossular
Si3Al2Mg3O12 Pyrop
Braunsasbest, ein Amphibol
(Fe{6.1}Mg{0.9})Si8O{23.5}(F{0.5}H{1.5})
N2H4CO Ausschnitt
Teflon-ähnliche Struktur (Polytetrafluorethen-ähnlich)
Man beachte die im Gegensatz zu Alkanen leicht verdrehte, schraubenartige Struktur.
C17H10F17IO
Kristall
Nur Fluoralkyl-Ketten
[Co(NH3)6]BF4Cl2 Hexaammincobalt(III) dichlorid tetrafluoroborat
[Co(NH3)6]3Cl4(N3)5 Hexaammincobalt(III) chlorid diazid
[Co(NH3)6]Cl(Cr2O7)
[Mg(H2O)6][CoCl4(H2O)2]
Tetraedrischer Tetraaqua-Komplex
| [Zn(H2O)6][ZnCl4] | Ausschnitt |
[Co(H2O)6][Ni(H2O)6](SO4)2
EDTA-Komplex von Cobalt(III) und mehrkerniger Molybdän-Komplex
| K4[Co(H2O)6][Co(C10H12N2O8)]2[Mo8O26] * 6H2O |
| Ausschnitt |
Hexafluorobenzen (Hexafluorobenzen) in 1:1 Kristall mit Naphtalin
Beispiel für eine Aren-Perfluoraren-Interaktion oder 'aromatic donor–acceptor interaction' (siehe z.B. hier. Partialladungen eines normalen Aromaten und eines fluorierten Aromaten: Partialladungen in Benzen und Partialladungen in Hexafluorbenzen)
C6F6 C10H8
Ethandiol und Ethandiolat als Liganden im gleichen Stoff
[Na2(C2H6O2)6][Cu(C2H4O2)2]
grosser Ausschnitt
Co-Kristall mit Malat
(C6H10N3O2)(C4H3O4) Histidin-malat
Cl2(N2H6)
In2O3
Polyeder
nur
Unitcell
I2 Iod
KN3
Polyeder
nur
Unitcell
Enthält das sehr aussergewöhnliche Bifluorid-Anion HF2-
K(HF2)
K[Co(CO3)2(C10H8N2)] * 2H2O
C12H12CoKN2O8
Ausschnitt
Modellkomplex für das Produkt der Biuret-Reaktion
K2[Cu(NHCONHCONH)2] * 4 H2O Kalium-bis-Biureto-cuprat(II) Tetrahydrat
K[Co(CO3)2(C2H8N2)] * H2O
C4H10CoKN2O7
Ausschnitt
K[Cu(C2H8N2)2][FeC6N6]
Bisethylendiaminkupfer(II)-hexacyanoferrat(III)
KClO3
KClO2
KF
K4[Fe(CN)N6] * 3H2O
C6H6FeK4N6O3
KHSO4
Kaliumsalz der Äpfelsäure
KC4H5O5*H2O
KNaC4H12O10
KNO3
KNO2
KO3
KClO4
KMnO4
K2S
K2S unter hohem Druck
K4C8H10O13
K2[PtCl4]
K[AuCl4] und K[AuBr4]
löschen:
KSCN
Beim Brennen zu Irdengut wird aus Tonmineralien wie Kaolinit chemisch gebundenes Wasser abgespalten. Die Wasserstoffbrücken zwischen den Tonschichten werden so nach und nach durch \"Sauerstoff-Brücken\" ersetzt. Über 1200°C wird Kaolinit vollständig in Mullit umgewandelt, der nadelförmige Kristalle bildet. während Feldspat dazwischen zu Glas schmiltzt und die Mullit-kristalle zusammenklebt. Auf diese Weise entsteht wasserundichtes Steinzeug.
Kaolinit, Al2Si2O9H4
Entweichen von "chemisch gebundenem Wasser":s
Kaolinit
mögliches Produkt
beide
Mullit, Al{2.25}Si{0.75}O{4.871}
cif
Glas (mögliche Struktur)
Netzwerkbildner bzw. -Wandler und Flussmittel Bortrioxid (Borsäureanhydrid, Bor(III)-oxid, für Borsäureglas, B2O3
C1 Graphen
C Graphit
cif
C Diamant
C Buckminster-Fulleren
C Kohlenstoff-Nanotube
C Kohlenstoff-Nanotube 2 (Link)
H20C14Diamantan
H14C32Ovalen
CO
Kohlenstoffdioxid
CO2
Modell: Wassercluster um CO2-Molekül
Quelle: Water structure and science
Modell: CO2-Molekül und OH--Ion in wässriger Lösung
Erstellt mit Odyssey
Wasserstoffbrücken lassen sich unter dem Reiter ZMWW einzeichnen.
Ausschnitt (unmittelbar benachbarte Wassermoleküle)
Kohlensäure
Röntgenstruktur von Kristallen, die bei einem Druck von 5 bis 6.5 GPa gewachsen waren.
H2CO3
pH-Indikator
Vgl. auch Phenolphthalein und Benzophenon
(C25H30N3)Cl * 9H2O Kristallviolett
CuCl Kupfer(I)-chlorid
| CuCl2 | Ausschnitt |
| CuCl2*2 H2O | Ausschnitt |
Cu(OH)2
Cu(NO3)2
Polyeder
nur
Unitcell
Hexahydrat [Cu(H2O)6](NO3)2
Polyeder
nur
Unitcell
Spezielle Oxidationsstufe
Cu3N
Polyeder
nur
Unitcell
|
CuSO4 |
|
| CuSO4*5 H2O Pentahydrat | A | B | C |
- Tetraaquakupfer-Komplex 1
- Tetraaquakupfer-Komplex 2
- Sulfat-Wasser-Cluster SO4-- * n H2O
C4H4CuO6 wasserfrei
Tetrahydrat C8H12Cu2O14 * 4(H2O)
Lidocain mit Menthol
C14H22N2O, C10H20O
LiBH4 Lithiumborhydrid, Lithiumboranat
LiBr
Polyeder
nur
Unitcell
Lithiumbromit im Cokristall mit Glukose
C36H72Br3Li3O36
LiCl
Lithiumethylenglycolat mit interessanter Wasserstoffbrücke
[Li(C2H5O2)]
LiF
Li2[Cu(C6H8O5)2]*8H2O Lithium-bis(1,6-anhydro-β-D-glucosidato(2-)-O,O)cuprat(II)
Kristall
LiI
Polyeder
nur
Unitcell
LiCoO2
Lithium-Cobalt(III)-oxid, Pluspol, Lithiumionen-Akku, entladen
CoO2
Cobalt(IV)-oxid, Pluspol, Lithiumionen-Akku, aufgeladen
(Li3{.39}Al{4.61}Si6, Heterographit-like)
Analogie des Minuspols eines aufgeladenen Lithiumionen-Akkus
Akku geladen
Akku entladen
LiMgN
Polyeder
nur
Unitcell
Li3N
Polyeder
nur
Unitcell
Li2C4H4O6
Li[Si(OCH2CH2OH)(OCH2CH2O)2]
C6H13LiO6Si
C6H15N2O2 * CHO2 Lysin-methanoat (Formiat)
MgF2
Veränderung des geladenen Ausschnitts:
Kation
Anion
alles
Polyeder bei gewählten
Mg(OH)2
Mg3N2
Polyeder
nur
Quelle: Materials Project
MgO
Fe3O4 bzw. Fe(III)[Fe(III)Fe(II)]O4, Magnetit
Dunkelbraun sind tetraedrisch gebundene Eisen(III), grau könnten octaedrisch gebundene Eisen(III)-Ionen sein, gleich viele octaedrisch gebundene Fe(II)-Ionen liegen zudem vor.
CoFe2O4 Cobalteisenstein mit Co(II) und Fe(III)-Ionen
TiCo2O4 Cobalttitanat mit Co(II) und Ti(IV)-Ionen
Cu2(OH)2(CO3) Malachit
C4H4O4
C3H4O4 Malonsäure
MnCl2 wasserfrei
MnCl2 * H2O Monohydrat
MnCl2 * 2H2O Dihydrat
MnCl2 * 4 H2O Tetrahydrat
Mn(NO3)2
Polyeder
nur
Komponenten der Alkali-Mangan-Batterie
MnO Mangan(II)-oxid
Mn2O3 Mangan(III)-Oxid
MnO2H Mangan(III)-oxid-hydroxid, γ-MnOOH, Groutit, (Alkali-Mangan-Batterie, entladen)
MnO2 β-MnO2 (Rutil-Struktur)
MnO2 γ-MnO2 (Alkali-Mangan-Batterien, aufgeladen)
Mangan(II)-gallat
Mn(C7H4O5)*2H2O
C7H8MnO7
Ausschnitt
C10H20O(-)-Menthol
H2CO
(HCOOH)(HF)
(HCOOH)(C4H4N2)
C6H12
C16H18N3S[AuCl2] Methylenblau-Gold(I)-dichlorid (Dichloroaurat(I))
[(C16H18N3S)AgCl2] Methylenblau-Silber(I)-Dichlorid
[(C16H18N3S)CuCl2] Methylenblau-Kupfer(I)-Dichlorid
3-Oxobutansäuremethylester, 3-Ketobuttersäuremethylester
C5H8O3
Interessante Geometrie: Trigonal-prismatische Geometrie (trigonal prismatic)
MoN
Polyeder
nur
Polyeder bei gewählten
Tonmineral
Al4Si8O24Ca
2(C4H10NO)+ ; [Si(C2H2O3)3]--
C14H26N2O11Si
C10H8
Polyethylenglycol(PEG)-ähnliches Molekül
C24H36O8
Organisches Ozonid
C19H13NO3
Kristallisiert in den regenerierbaren Wärmebeuteln aus.
NaCH3COO * 3H2O Trihydrat
Geometrie des Anions: Verzerrtes Oktaeder: Trigonal antiprismatisch.
NaN3
Polyeder
nur
Polyeder bei gewählten
Enthält das sehr aussergewöhnliche Bifluorid-Anion HF2-
Na(HF2)
Na[Si(OCH3)(OCH2CH2O)2]
C5H11NaO5Si
Na2CO3
Na2CO3 * H2O
NaCl Kochsalz
Polyeder bei gewählten
Na2S2O4 Natriumdithionit
NaF
Polyeder bei gewählten
NaH2{NTA} * 2(H2O)
C6H12NNaO8
Ausschnitt
Bemerkenswerte Position des H-Kernes!
NaHCO3
NaOH
NaNO3
Na3N
Polyeder
nur
Polyeder bei gewählten
Na2HPO3 * 5H2O
Na2O
Mit Polyedern
Na5(CoO3)OH
NaO3
Na2SO4 * 10 H2O Natriumsulfat Decahydrat
cif
Salz mit dem Superoxid-Radikal-Anion
NaO2
Na2C4H4O6 Natriumtartrat
NaC4H7O7 Natriumhydrogentartrat
Borax, Dinatriumtetraborat Dodecahydrat
Na2[B4O5(OH)4] * 8 H2O
Na2B4O7 Natriumtetraborat wasserfrei
Ausschnitt
Beim Lösen in Wasser bildet sich aus Natriumtetraborat Borsäure:[B4O7]-- {+} 7 H2O {⇄} 2 B(OH)4- {+} 2 B(OH)3
Orthoborsäure
B(OH)3
In Wasser reagiert Borsäure wie eine einprotonige Säure mit einem pKS von 9.25 zum Tetrahydroxoborat-Ion [B(OH)4]-
B(OH)4- Tetrahydroxoborat-Ion
Metaborsäure
Metaborsäure existiert in verschiedenen Modifikationen
HBO2 orthorombisch
HBO2 monoklin
HBO2 kubisch
Na2(S2O3)*5 H2O
Na[Cl3CSO3] * H2O Monohydrat
[Ni(N2O2C4H7)2]
C8H14N4NiO4
Ausschnitt
C21H27N7O14P2 (oxidierte Form)
C21H29N7O14P2 (reduzierte Form)
NAD 1 NAD 2 NAD 3
C6H9NO6
Ausschnitt
C6H5NO3m-Nitrophenol
C6H5NO3p-Nitrophenol
C14H8N2O7
C16H24
C14H17N3O3 * H2O L-Alanyl-tryptophan Monohydrat
C8H16N2O3S * {0.5} H2O L-Alanyl-L-methionin Hemihydrat
C13H15N3O3 * 2H2O Glycyltryptophan Dihydrat
C17H25N3O5 , C3H8O , 2H2O Glycyl-L-Leucyl-L-Tyrosin Dihydrat 2-Propanol solvat
Ein Feldspat, Al3+ ersetzen rund 50% der Si
(Al{1.41}Si{2.59})(Ba{0.4}K{0.47}Na{0.13})O8
Orthoklas Polyeder
Das Sesquihydrat enthält Oxoniumionen
C2H2O4 * 2 H2O Dihydrat
C2H2O4 * 1.5 H2O Sesquihydrat
Oxonium- (bzw. Hydroxonium)-Salz der Hypodiphosphorsäure
(H3O)2(H2P2O6)
C8H9NO2
[Co(OCONH2)(NH3)5](NO3)2
[Co(NH3)5Cl][PdCl4]
Chlorid-Ionen als Ligand und als Gegenion
[Ga(NH3)5Cl]Cl2Pentaamminchlorogallium(III)-chlorid
[RuCl(NH3)5]HSO4*4H2O
[Co(NO2)(N H3)5]Br2
[Co(NO2)(N H3)5]Cl2
CaTiO3 Perowskit
BaTiO3 Unverzerrte Perowskit-Struktur
C6H6O Drei Moleküle
C6H6O Ebene
C6H6O Kristall
pH-Indikator
Deprotoniertes Phenolphthalein: Vgl. die Strukturen von Kristallviolett und Benzophenon
C20H14O4 Phenolphthalein
(C36H30P2N)2[VF2O(P3O9)] * 2 H2CCl2 cyclotrimetaphosphatodifluorooxovanadat(V)
(C36H30P2N)2[Mo(CO)2(C3H5)(P3O9)] Cyclo-trimetaphosphat-Molybdän(III)-Komplex
(C36H30P2N)4[Co(P3O9)2] * 2 CH3CN Di-cyclo-trimetaphosphat-Cobalt(II)-Komplex
KFeP2O7Kalium-eisen(III)-diphosphat
(N H4)3[Mo12O40P]*21H2O Molybdat- oder Phosphat-Nachweis: Gibt man zu einer sauren Molybdat-Lösung Phosphat-Spezies, so fällt diese gelbe Struktur aus (Mischoxid), die von Ascorbinsäure zu einer blauen Struktur reduziert wird
P Schwarzer Phosphor
P violetter Phosphor
P roter Phosphor
P4 Weisser Phosphor
P2O5 Phosphorpentoxid, stabile orthorhombische Form
P4O10 Phosphorpentoxid, metastabile trigonale Struktur
H3PO4
C8H6O4
2,4,6-Trinitrophenol
C6H3N3O7 Pikrinsäure
C13H14, C6H3N3O7 Donor-Acceptor Komplex zwischen 4,6,8-Trimethylazulene and Pikrinsäure
(H3O)(C6H2N3O7) Hydroxoniumpicrat
C10H16 α-Pinen
C10H16 β-Pinen
Bei den hier dargestellten Kohlenhydraten handelt es sich um berechnete Modelle, nicht um Kristallstrukturen
Siehe auch Amylose, Chitin oder Cellulose
Ausschnitte von
Amylopectin 5 Glucoseeinheiten (Proteopedia) (Form von Stärke)
Amylopectin 1 (Proteopedia) (Form von Stärke)
Amylopectin 2(BioTopics) (Form von Stärke)
Glycogen (Proteopedia)
Hyaluronsäure (Proteopedia)
Molekulare Küche
Alginat mit 4 α-L-Guluronsäure-Einheiten (Verknüpfungen axial) und 4 β-D-Mannuronsäureeinheiten (Verknüfpungen äquatorial)
Alginat mit 4 α-L-Guluronsäure-Einheiten und 4 β-D-Mannuronsäureeinheiten im Komplex mit Calciumionen
Alginat: zwei Stränge mit zwei Ca-Ionen-Egg-Boxes mit Koordinationszahlen 7 und 8
Xanthan, Rückgrat aus 5 Glucosemolekülen mit zwei Seitenketten (eine mit Brenztraubensäure-Ketal)
C5H9N1O2 * H2O
C3H8
C3H6O Propanon, Aceton
C3H6O2
Propionsäuremethylester, Methylpropionat
C4H8O2
C10H9N2+, I3- 2,2'-Bipyridiniumtriiodid
FeS2 Pyrit, Eisen(II)-disulfid
FeS2 Markasit, Eisen(II)-disulfid
(ribonucleic acid, RNA)
t-RNA (Transfer-RNA)
C7H6O3 Salicylsäure (o-Hydroxybenzoesäure)
C7H6O3 p-Hydroxybenzoesäure
HNO3
HNO3 * 2 H2O, Dihydrat
(H3O)(NO3) * H2O, Hydroxoniumnitrat Monohydrat
[Fe(C5H5)2][AlCl4], Ferrocenium-tetrachloroaluminat
[Re(C9H10N1O3)(C1O1)3]Tricarbonyl[3-(h5-cyclopentadienylcarbonylamino)propionsäure]rhenium
C26H50OSi4U,
O2 Disauerstoff
S8, Rhombischer Schwefel
Zwei Moleküle
Kristallgitter
SF6
SO2 Schwefeldioxid
SO3, S3O9 Schwefeltrioxid
H2SO4
H2S2O7 Dischwefelsäure
(H3O)(HSO4) Schwefelsäure Monohydrat; Oxonium-Salz der Schwefelsäure (Hydroxoniumhydrogensulfat)
Zwei verschiedene Formen (Kristallstrukturen)
C3H7NO3 β-Glycin
AgN3
AgCl
AgF
AgI
AgNO3
Ag[MnO4]
Silizium
Si
SiO2
Tiefquarz, α-Quarz, bei Normdruck stabil unter 573 °C, piezoelektrisch. Die Achsen a und b enstsprechen den Achsen a und b in Jmol.
Schraubenpaar entlang c-Achse. In Links-Quarz (linkshändigem, linkshändischem Quarz) winden sich diese Tetraederschrauben im Uhrzeigersinn um die c-Achse dem Betrachter entgegen, in Rechts-Quarz im Gegenuhrzeigersinn. Gezeigt ist hier somit ein Rechts-Quarz:
Schraube 1
Schraube 2
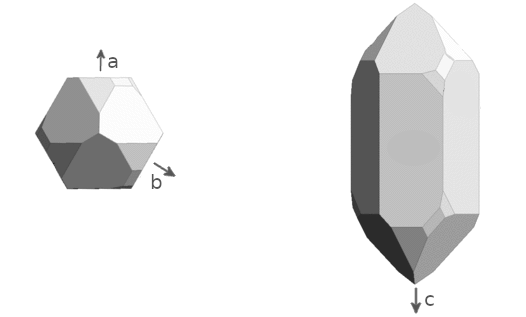
Rechtsquarz, betrachtet in Richtung der c-Achse (links) und der a-Achse (rechts).
α-Quarz ist bezüglich Krafteinwirkung entlang der a-Achsen (Achse a, Achse b und ihre Winkelhalbierende) piezoelektrisch.
Piezoelektrischer Effekt: Wenn ein elektrisches Feld in Richtung der a-Achse angelegt wird, verändert sich die Ausdehung des Kristalls in dieser Richtung: In dieser Abbildung drehen sich die blauen Tetraeder um ihre jeweilige Verbindungsachse zum Silicium-Atom des grauen Tetraeders, während der graue Tetraeder um die a-Achse verdreht wird.
Hochquarz, β-Quarz, bei Normdruck stabil über 573 °C, aufgrund der höheren Symmetrie nicht piezoelektrisch
Schraubenpaar entlang c-Achse. In Links-Quarz (linkshändigem, linkshändischem Quarz) winden sich diese Tetraederschrauben im Uhrzeigersinn um die c-Achse dem Betrachter entgegen, in Rechts-Quarz im Gegenuhrzeigersinn. Gezeigt ist hier somit ein Rechts-Quarz:
Schraube 1
Schraube 2
Cristobalit
Opal ist amorphes SiO2 mit 4-9% Wasser:
Mikroskopisch , Makroskopisch
C6H14O6
γ-Sorbitol 1
γ-Sorbitol 2
γ-Sorbitol 3
ε-D-Sorbitol
N2O3
Produkt der Reaktion von Stickstoffdioxid mit Stickstoffmonoxid bei tiefen Temperaturen:
NO {+} NO2 ⇌ N2O4
N2O4 Distickstoff tetroxid
Im Gleichgewicht mit Sticktoffdioxid 2 NO2 ⇌ N2O4
N-N-Bindung
N2
HN3
1,2-Diphenylethen
C14H12
gross, C14H12
C8H8
[Sr(C4H5O5)2(H2O)4]*2H2O
Sr(NO3)2
Polyeder
nur
Ausschnitt
Unitcell
Polyeder bei gewählten
Sr(S2O3)*5H2O
Haushaltszucker, Sucrose, Saccharose
C12H22O11
Sucrose 1
Sucrose 2
Sucrose 3
Acetanilid
C8H9NO
4-Acetamidobenzensulfonamid
C8H10N2O3S
δ-Sulfanilamid
C6H8N2O2S
Sulfanilamid-Amidosulfonsäure-Salz
C6H9N2O2S+, H2NO3S-
Sulfanilamid-Dinitrosalicylsäure-Salz
C7H3N2O7+, C6H9N2O2S-
Sulfamethoxazol-bromid
C10H12N3O3S+, Br-
Sulfamethoxazol-nitrat
C10H12N3O3S+, NO3-
Ta3N5
Polyeder
nur
Polyeder bei gewählten
C8H6O4
Ein Molekül
Eine Ebene
Mehrere Ebenen
[Co(CO3)(NH3)4]NO3
[Cu(NH3)4(NO3)2]
CuH12N6O6
[Cu(NH3)4)2][(Cu(NH3)2)2][(Ni(CN)4)4]
C16H36Cu4N28Ni4
[Pt(NH3)4][PtI4]
Rb[Rb(HF)4][TcF(NO)(NH3)4]4F6
Der Phenylboratkomplex vermag verschiedene einfach geladene Kationen zu fällen, so Kalium- (als K[B(C6H5)4]]), Ammonium-, Thallium-, Rubidium- oder Caesiumionen. Natriumtetraphenylborat ist hingegen wasserlöslich
NH4[B(C6H5)4]] Ammoniumtetraphenylborat
Na[B(C6H5)4]] Natriumtetraphenylborat
Rb[B(C6H5)4]] Rubidiumtetraphenylborat
Cs[B(C6H5)4]] Caesiumtetraphenylborat
K[TcF(NO)(NH3)4]2(PF6)3
TlF
Clathrat aus Thioharnstoff (thiourea) und Cyclohexan
C8H12*3CH4N2S
[Co(Se)3(NH3)4]NO3 * H2O
Tetraedrischer Tetraaqua-Komplex, Chelidonat
| [Be(H2O)4]C7H2O6 | Ausschnitt |
[Th{EDTA}(H2O)4]
C10H20N2O12Th
Ausschnitt
Tetraedrischer Tetraaqua-Komplex
Tetraaqualithium(I) bis(tropolonato-O,O')lithate(I)
| [Li(H2O)4][Li(C7H5O2)2] | Ausschnitt |
Salicylato-Komplex mit Koordinationszahl 9
C112H107Ce2Fe4N8O45
C4H12NI5
Kristall
Pentachlorostannat-Komplex
| [C24H20P][Sn Cl5] | Ausschnitt |
Weisser Phosphor als Ligand
[Au(P4)2][GaCl4]
Rutil und Anatas-Modifikation werden als Weisspigment und Photokatalysator verwendet. Dabei ist Anatas photochemisch aktiver, also für photochemische Anwendungen geeigneter, als Weisspigment hingegen zerstört Anatas eher organische Moleküle
TiO2 Rutil
TiO2 Anatas
C17H18Cl1Mn1N2O10
C3H5Cl3
Gallussäure Monohydrat
C7H6O5 * H2O
Na3Li3[Co2F6]2
C54H139{.6}Cl2Cu6Fe3N42O23{.8}
mer-Tris(β-Alaninato)-cobalt(III) Dihydrat
[Co(C3H6N1O2)3]*2H2O Dihydrat
Racemische Verbindung (beide Enantionmere im Verhältnis 1:1)
[Co(C2H8N2)3]Cl2
C6H24Cl2CoN6
[Co({en})3]Cl C4H4O6 * 5 H2O
H38C10N6O11Cl1Co1
Ausschnitt
beide Tris(ethylendiamin)cobalt(III)-Enantiomere
{(+)-}[Co(en)3]2{((+)-tart)2}{((+)-Htart)2} * 4 H2O
[Co(C2H8N2)3]2(C4H4O6)2(C4H5O6)2 * 4 H2O
Ansicht 1
Ebene
"Wasserfäden"
[Co({en})3]I3 * H2O
C6H26CoI3N6O
(-)-Enantiomer
(+)-Enantiomer
[Ni(C2H8N2)3](C2H3O2)2
[C6H24N6Ni](C4H4O6) * H2O
C10H30N6Ni1O7
Tris(ethylenediamin)-nickel(II)-d,l-tartrat Monohydrat
Ausschnitt (Ebene)
[C6H24N6Ni]3(C4H4O6)3 * 4 H2O
C30H92N18Ni3O22
Tris(ethylenediamin)-nickel(II)-d-tartrat Dihydrat
Ausschnitt 1 (Situation Nickelion 1)
Ausschnitt 2 (Situation Nickelion 2)
Ausschnitt 3 (Situation Nickelion 2)
[Co(C2H4N1O2)3] Tris(glycinato-N,O)cobalt(III)
[Co(C2H4N1O2)3]*H2O Monohydrat
C11H12N2O2 * HCOOH Tryptophan Ameisensäure Solvat
Na{0.46}Ca{0.3}Al{7.83}Li{0.9}Si{5.58}B{3.42} F{0.5}O{30.5}H{3.501}, Elbait
Uranhexafluorid
UF6
Uran(III)-nitrid
UN
Polyeder
nur
Polyeder bei gewählten
Uran(IV),(V)-nitrid
U2N3
Polyeder
nur
Polyeder bei gewählten
VO2 Vanadium(IV)-Oxid
V2O3 Vanadium(III)-Oxid
V2O5 Vanadium(V)-Oxid
Ungewöhnlich: Deprotonierung der Tatrat-Ionen an den Hydroxygruppen und die mehrkernigen Komplexe.
C40H96N4O26V4
((NEt4)4[V4O8((R,R){-}tart)2])
Ausschnitt
Wasserstoffbrücken beim Reiter ZMWW einzeichnen
H2O Eis Ih (hexagonal)
cif-Datei
Clathrat
cif
Clathrat: Methanhydrat | Ausschnitte
A
B
Modelle Quelle: Water structure and science
Wassercluster um Sulfat-Ion
Wassercluster um Hydroxonium-Ion
Wassercluster um CO2-Molekül
| H2O2 | Ausschnitt |
C4H6O6
C5H12O5
Xylitol 1
Xylitol 2
Xylitol 3
Zement
Wollastonit, CaSiO3
Tobermorit, Si3O9Ca3H
Beton
Ettringit, (kein Silikat) Ca6Al2S3O{49.496}H{60.602}
... ohne Wasser
Afwillit, Ca3Si2O10H6
Hillebrandit, (einzelne O-Atome: Wasser) Ca3Si{1.5}O{7.5}H2
Jennit (Wasser und Hydroxid-Ionen: Magenta) Ca9Si6O32H22
Thaumasit Ca3SiCSO25H30
Tetracalcium-dialuminium-dodecahydroxid-carbonate Pentahydrat
Zementartige Substanz
3CaO * Al2O3 * CaCO3 * 11H2O
Zeolith A, Ag{10.7}K{1.3}(Al12Si12O48)
ohne Gegenionen
Zeolith L (ohne Porenwasser), K6Na3(Al9Si27)O93H42
Heulandit Si{13.554}Al{4.446}O{44.08}Pb2
ohne Gegenionen
Offretit, Si{12.78}Al{5.22}Ca{1.4}KMgO{49.52}H{27.04}
... ohne Wasser
Stellerit, Ca{0.78}Na{0.1}K{0.01}Si{7.92}Al{1.98}O{25.24}H{14.48}
... ohne Wasser
Mesolit, Na2Ca2Al6Si9O38H16
ZnCl2 Zink(II)-chlorid
Polyeder bei gewählten
Zn(OH)2
[Zn(C8H15O2)2]
Mäusegift
Zn3P2
Polyeder
Polyeder, Ausschnitt
Polyeder aus
Ionenradien
α-ZnS Zinkblende, Sphalerit
β-ZnS Wurtzit
Polyeder bei gewählten
Sn(NO3)4
Ausschnitt
Polyeder bei gewählten
ZrC
Polyeder
nur
Polyeder bei gewählten
Zirkonium(III)-nitrid
ZrN
Polyeder
nur
Polyeder bei gewählten
Zirkonium(IV)-nitrid
Zr3N4
Polyeder
nur
Polyeder bei gewählten
Für keramische Klingen wird kubisches Zirkonium(IV)-oxid verwendet. Damit sich das Volumen des Materials beim Abkühlen nicht verändert, wird Zirkonium(IV)-oxid durch Dotierung (z.B. einige Prozent Yttrium) in der kubischen hochtemperatur-Modifikation stabilisiert. Beachte die seltsame Koordinationszahl des Zr in der monoklinen Modifikation. Keramische Antihaftbeschichtungen bei Bratpfannen bestehen demgegenüber oft aus Dünnschicht-Siliciumdioxid
ZrO2 kubisch
ZrO2 monoklin