Wasserstoffbrücken
© Urs Leisinger 2014
Einleitung
I. Dipol-Moleküle
II. Wasser und Eis
III. Fluorwasserstoff
IV. Maleinsäure
V. Harnstoff
VI. Terephthalsäure
VII. Phenol
VIII. Glucose
IX. Aussergewöhnliche H-Brücken zwischen Ionen
X. DNA
Einleitung
Lange Zeit war es nur über komplizierte Überlegungen möglich, sich ein Bild von der Anordnung von Atomen in Molekülen zu machen. Für viele Naturwissenschafter waren Atome und Moleküle denn auch reine Fiktion. Zu Beginn des 20 Jahrhunderts wurde aber Verfahren entwickelt, mit dem man sich wenigstens von Atomen in Kristallen ein recht gutes Bild machen konnte: Röntgen-Kristallstrukturanalyse. Für den Moment reicht es, zu wissen, dass man mit Röngenstrahlung in einem aufwändigen Verfahren Informationen über die Anordnung von Atomen oder Ionen in Kristallen ermitteln kann. Das ermöglicht es, in diesen Kristallen die Auswirkungen der zwischenmolekularen Wechselwirkungen -– und vieles mehr - zu studieren.
Ein Hinweis zu Jmol: die wichtigsten Tips zum Arbeiten mit dieser Seite werden im Abschnitt Einführung gegeben.
Eine Vorlage zum Beantworten der Fragen gibt es hier.
Quelle: Snowcrystals.com
I. Dipol-Moleküle
- Manche der folgenden Dipol-Moleküle enthalten zwar Wasserstoff-Halbbrücken; trotzdem sind in den Reinstoffen keine Wasserstoffbrücken möglich. Weshalb?
- Alle diese Moleküle sind aber Dipole, und so sind in den Reinstoffen Dipol/Dipol-Wechselwirkungen möglich. Ordnen sich die Moleküle in den Kristallen genau so an, wie man dies gemäss Schulbuch erwarten würde?
IIa. Eis
Wasser
Zur Erinnerung: Durch Anklicken können verschiedene Grössen gemessen werden:
- Distanz zwischen zwei Atomen: erstes Atom doppelklicken, dann zweites Atom doppelklicken
- Winkel: Erstes Atom doppelklicken, zweites Atom einmal anklicken, drittes Atom doppelklicken
Um eine einzelne Messung zu löschen, führt man sie ein zweites mal aus (d.h. dieselben Atome nochmals anklicken).
- Wie gross sollte der Abstand zwischen dem O- und H-Atom gemäss Periodensystem sein? Wie gross ist der Abstand tatsächlich?
- Wie gross sollte der Bindungswinkel am O-Atom gemäss Ladungswolkenmodell sein? Wie gross ist er tatsächlich?
- Wechsle nun oben zur Ansicht Partialladungen. Welche Farbe stellt eine positive Partialladung, welche eine negative dar?
- Wechsle zum Ausschnitt aus dem Eiskristall. Wie viel mal länger ist eine Wasserstoffbrücke etwa als eine H-O-Bindung?
- Sind die Wasserstoffbrücken genau linear? D. h. sind die Winkel an der positiven Halbbrücke in Eiskristallen genau 180°C? Falls nein: wie gross sind diese Winkel typischerweise etwa.
- Zeichne nun mindestens fünf H-Brücken ein, indem du die Entfernungen zwischen den Halbbrücken misst. Lass die Abbildung drehen, stelle auf Stereo und betrachte den Eiskristall durch die Stereobrille. Drehe die Abbildung so, dass man die Struktur möglichst gut sieht und speichere die Abbildung.
- Miss den Abstand zwischen zwei Sauerstoff-Atomen, die über eine Wasserstoffbrücke miteinander verbunden sind. Miss dann den Abstand zwischen zwei benachbarten Sauerstoffatomen in elementarem Sauerstoff bei sehr tiefen Temperaturen. Hättest du dieses Grössenverhältnis erwartet?
Die Wassermoleküle in Eis sind in dauernder Bewegung. Sie vibrieren, drehen sich und schwingen um ihre Ruhelage, tatsächlich muss man sich die abgebildeten Moleküle und Kristalle also in dauernder Bewegung vorstellen. Betrachte die drei möglichen Grundschwingungen von Wasser (dazu gibt es keine Aufgabe zu lösen):
IIb. Flüssiges Wasser (Computermodelle)
Folgende Proben zeigen Eis bzw. einen kleinen Ausschnitt aus flüssigem Wasser ("flüssiges Wasser Ausschnitt"). Die flüssige Probe unterscheidet sich vom Eis in vielerlei Hinsicht z.B. bezüglich
- der durchschnittlichen Anzahl Wasserstoffbrücken pro Molekül,
- dem gesamten Netz an Wasserstoffbrücken,
- der Grösse der kreisförmigen Strukturen, welche die Wassermoleküle bilden,
- wie komplett die Moleküle den Raum füllen.
Aufgaben
- Erkläre anhand dieser Unterschiede, weshalb die eine Probe fest, die andere flüssig ist...
- und weshalb Eis auf Wasser schwimmt, während die meisten anderen Feststoffe in ihrer Schmelze versinken.
- Wie kann eine Erwärmung auf der Ebene der kleinsten Teilchen zu solchen Veränderungen führen?
- Beschreibe, was im Verlauf der Zeit vermutlich mit der flüssigen Probe auf Teilchenebene geschieht (die Probe soll sich dabei weder abkühlen noch erhitzen).
- Betrachte nun das Modell "Flüssiges Wasser bei 0.2 °C (Odyssey)". Einige Wasserstoffbrücken sind bereits eingezeichnet, Stelle eine Hypothese auf: Weshalb erreicht Wasser seine grösste Dichte bei 4°C und nicht bei 0°C?
Genauere Computermodelle von flüssigem Wasser und Wasseroberflächen
Quiz
- Wähle die grösste Atomgrösse an, um einen ungefähren Eindruck von den Ausdehnungen der Atome und Moleküle zu erhalten. Enthält flüssiges Wasser ebenso viele und ebenso grosse Lücken zwischen den Molekülen wie Eis? Vergleiche mit der Situation in Eiskristallen und in den Kristallen der Dioplmoleküle.

Quelle: Snowcrystals.com
III. Fluorwasserstoff und Chlorwasserstoff
HF
- Stelle eine Hypothese auf: Weshalb ordnen sich die Fluorwasserstoffmoleküle in festem Fluorwasserstoff in so seltsamen Zickzacklinien an?
IV. Maleinsäure
Maleinsäure
- Zeichne in der Abbildung "eine Ebene" zwei grundlegend verschiedene Wasserstoffbrücken ein und speichere die Abbildung
- Erkläre die Anordnung der Maleinsäuremoleküle im Maleinsäurekristall mit Hilfe der zwischenmolekularen Wechselwirkungen: Welche Wechselwirkungen kommen wo zum Zug?
- Welche Distanz ist grösser: Die Distanz zwischen zwei O-Atomen, die über ein H-Atom bzw. eine Wasserstoffbrücke verbunden sind, oder zwischen zwei O-Atomen, die in verschiedenen Molekül-Ebenen liegen, aber benachbart sind? War das so zu erwarten?
V. Harnstoff
Harnstoff
- Wird die Anordnung der Harnstoffmoleküle im Harnstoffkristall eher durch Dipol/Dipol-Wechselwirkungen oder eher durch Wasserstoffbrücken dirigiert? Diskutiere anhand der Kristallstruktur.
VI. Terephthalsäure
Terephthalssäure
- Betrachte zuerst nur ein einzelnes Terephthalsäuremolekül. Nicht mogeln, wirklich nur den linken Knopf "ein Molekül" anwählen! Skizziere nun diejenige Anordnung zweier Moleküle auf Papier, in der die zwischenmolekularen Wechselwirkungen deiner Meinung nach möglichst gross sind. Noch immer nicht mogeln!
- Schaue dir dann die anderen Abbildungen (eine Ebene / mehrere Ebenen) an. Trifft deine Vorhersage zu? Inwiefern trifft sie nicht zu?

Terephthalsäure ist ein Ausgangsstoff für die Herstellung von PET-Flaschen. Quelle.
VII. Phenol
Phenol
- Versuche, die Anordnung von Phenolmolekülen im Kristall mit zwischenmolekularen Wechselwirkungen zu erklären.
VIII. Glucose
Glucose
- Glucose-Kristalle sind hart wegen der Wasserstoffbrücken zwischen benachbarten Glucosemoleküle. Wie viele Wasserstoffbrücken geht ein Glucosemolekül durchschnittlich mit einem anderen ein?
IX. Seltsame Wasserstoffbrücken in Ionen
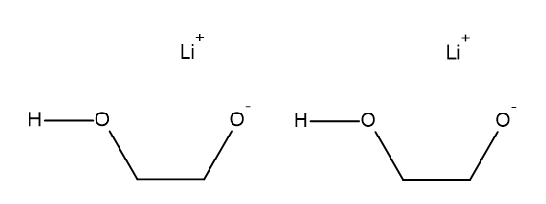
Lithium-ethandiolat
Lithiumglycolat ist ein Salz aus Lithium- und Ethandiolat-Ionen (auch: Glycolat-Ionen, siehe Skelettformeln unten). Zwischen den Ethandiolat-Ionen existieren sehr ungewöhnliche Wasserstoffbrücken. Was ist daran ungewöhnlich? Vergleiche mit den Längen von Wasserstoffbrücken in Wasser oder gewöhnlichen Alkoholen.
Hinweis: diese seltsamen Wasserstoffbrücken haben damit zu tun, dass sich die an den Wasserstoffbrücken beteiligten Elektronenpaare beträchtlich "verformen", wenn Wasserstoffbrücken gebildet werden.
Studiere zum Schluss folgenden Abschnitt über Wasserstoffbrücken und DNA
DNA besteht aus zwei riesigen Ionen (sogenannte DNA-Stränge), die über Wasserstoffbrücken zusammengehalten werden. Wie lassen sich diese Wasserstoffbrücken charakterisieren? Folgende Animation zeigt einen kurzen Ausschnitt der DNA und zerlegt sie dann Stück um Stück, so dass man die Wasserstoffbrücken jedes Abschnitts erkennen kann.
DNA
Ganze Animation
In Einzelschritten (mit Start beginnen)
Diese Wasserstoffbrücken spielen bei der DNA-Verdoppelung (DNA-Replikation) eine grosser Rolle. Dabei werden die beiden Stränge getrennt, und zu jedem Strang wird ein neuer Gegenstrang synthetisiert. Die einzelnen Bausteine werden dabei dank der Wasserstoffbrücken in der richtigen Reihenfolge aneinander gehängt:
DNA-Replikation
Auf welche Weise speichert DNA die Erb-Information?
Die Aufgaben sind nun gelöst

