|
||||||||||
|
|
||||||||||
|
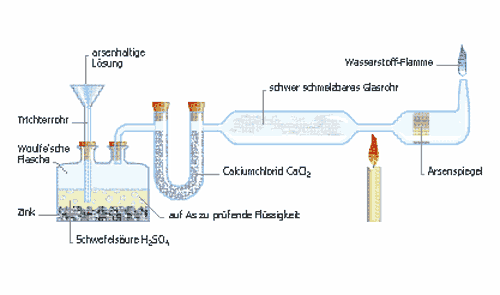
Einleitung Warum war Arsen eine beliebte Mordwaffe? Nachweis von Arsen mit Hilfe des Marsh-Tests Einleitung Arsen und seine Verbindungen gelten als sehr giftige und krebserregende Stoffe. Als Spurenelement ist es aber ein natürlicher Bestandteil des menschlichen Körpers. Arsen gelangt auf zwei Wegen in die Nahrungskette des Menschen, aus natürlichen Quellen und aus der Industrie. In der Industrie kommt es in verschiedenen Formen vor, die sich aber in ihrer Giftigkeit erheblich unterscheiden. Die wichtigste und eine der giftigsten Arsenverbindung, ist das Arsentrioxid (Arsenik As2O3), das nach wie vor in der Industrie am häufigsten anfällt. In der Medizin gehören organische Arsenverbindungen zu den ersten wirksamen Chemotherapeutika (z.b.Salvarsan®). Heute wurden fast alle arsenhaltigen Arzneimittel durch weniger toxische Verbindungen abgelöst. Daher kommt eine Arsenvergiftung aus medizinischen Gründen nicht mehr vor, sondern meistens nur noch als Berufserkrankung bei der Verarbeitung von arsenhaltigen Erzen und Metalle. Warum war Arsen eine beliebte Mordwaffe? Im Mittelalter und in der Renaissance (ca.16. Jh.) war das Arsenik sehr beliebt für Giftmorde. Es war allgemein bekannt, dass das pulverförmige Arsenik geruch- und geschmacklos war, und daher leicht in Suppen, Gebäcken und Getränken verabreicht werden konnte. Es war auch bekannt, dass Arsenikvergiftete Menschen, die Symptome, der damals sehr verbreiteten Krankheit Cholera Nostra, aufwiesen. Es gab also keine Mittel um einen Tod, als Folge einer Arsenikvergiftung, nachzuweisen. Durch den englischen Chemiker James Marsh, verlor Arsenik, als Mordinstrument an seiner Attraktivität. Denn er erfand 1836 ein Verfahren, mit dem Spuren von Arsenik auch in Leichenteilen nachgewiesen werden konnten. Nachweis von Arsen mit Hilfe des Marsh-Tests Mit Hilfe des Marsh-Tests können kleinste Arsenmengen (bis zu 0.00001 mg) chemisch nachgewiesen werden. Er wird auch heute noch in der Gerichtsmedizin angewendet.
Der Behälter ganz links wird mit Zink und verdünnter Schwefelsäure gefüllt. Hier wird auch die zu untersuchende Probe hineingegeben und anschliessend wird der Behälter verschlossen. Ist in der probe Arsenik vorhanden, so reagiert es mit dem, aus der Reaktion von Zink und der Schwefelsäure entstandenem Wasserstoff zu leicht flüchtigem Arsenwasserstoff. As2O3 + 6H2 → 2AsH3 + 3H2O Dieser entweicht aus dem Behälter, in das sich verjüngende Glasrohr, unter welchem sich ein Brenner befindet. Die Flamme des Brenners zersetzt den Arsenwasserstoff durch Wärmeeinwirkung in die beiden Elemente Arsen und Wasserstoff. 2AsH3 → 2As + 3H2 So scheidet sich an der Glaswand ein metallischer Arsenspiegel ab. Erhitzt man den leicht entzündbaren Arsenwasserstoff nicht an der verjüngenden Stelle, sondern am Ende der Apparatur (ganz rechts) so verbrennt die arsenhaltige Gasmischung mit schwachblauer Flamme, wobei wieder Arsenoxid entsteht, das man am weissen Rauch erkennt. Hält man ein Porzellanschälchen in die blaue Flamme, so scheidet sich an der glasierten Schälchenwand Arsen als schwarzer Belag ab. Quellenangaben Dossier Projektarbeit Giftmorde M.Widmer, S.Gysin, B.Peppin 1995 |
||||||||||